Mol là gì ? Đây là kiến thức quan trọng mà chúng ta đã được làm quen trong chương trình hóa học lớp 8. Để nắm rõ tất tần tật các kiến thức về định mol là gì, cùng một số thông tin tổng quan về mol, mời các bạn cùng theo dõi bài viết được chúng tôi chia sẻ dưới đây.
NỘI DUNG BÀI VIẾT
Khái niệm mol là gì?
Mol là lượng chất có chứa xấp xỉ 6,022.10²³ số hạt đơn vị nguyên tử hoặc phân tử của chất đó. Con số 6.02214129(27)x10²³ được gọi là hằng số Avogadro, có ký hiệu là NA. Tên gọi “mol” được đặt tên theo nhà hóa học Wilhelm Ostwald vào năm 1894 dựa theo từ molekül tiếng Đức (nghĩa là “phân tử”).

Mol là lượng chất chứa ~6,022.10²³ số hạt nguyên tử hoặc phân tử của chất đó
Mol là một đơn vị đo lường cơ bản sử dụng cho các hạt vi mô, thuộc hệ quy chuẩn SI. Mol được chia thành 2 loại, gồm mol phân tử và mol nguyên tử. Trong các phép biến đổi các đại lượng, ta có thể làm tròn N ≈ 6,022.10²³.
Ví dụ:
- 1 mol Al: Một mol nguyên tử nhôm là một lượng nhôm có chứa N nguyên tử Al.
- 1 mol H₂O: Một mol phân tử nước là một lượng nước có chứa N phân tử H₂O.
Mol được sử dụng phổ biến trong hóa học như một cách thể hiện lượng chất phản ứng và sản phẩm của các phản ứng hóa học. Ví dụ, phương trình hóa học: 2H₂ + O₂ → 2H₂O, được hiểu là 2 model H₂ (Hidro) và 1 mol O₂ (Oxi), phản ứng tạo thành 2 mol H₂O (nước).
Mol nguyên tử và mol phân tử
Nguyên tử và phân tử đều là những hạt vi mô. Kích thước của chúng nhỏ hơn hạt cát hàng nghìn, hàng vạn lần mà mắt thường không nhìn thấy được. Vì vậy mà đơn vị đo lường dành cho các hạt vĩ mô không thể áp dụng. Vì vậy, mol là đơn vị đo lường được các nhà khoa học đề xuất dành riêng cho các hạt vi mô này. Theo đó, khái niệm mol nguyên tử và mol phân tử lại có sự khác biệt riêng.
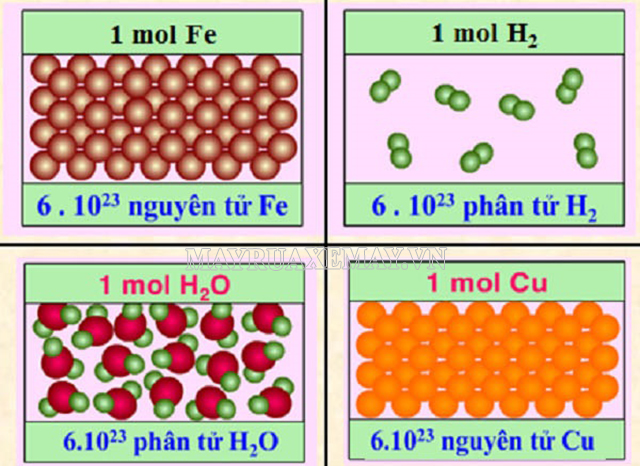
Mol nguyên tử và mol phân tử là hai khái niệm khác nhau
- Mol nguyên tử của nguyên tố chính là lượng nguyên tố có chứa NA nguyên tử của nguyên tố đó. Ví dụ: 1 mol nguyên tử oxi O₂ chứa 6,022.10²³ nguyên tử O₂.
- Mol phân tử của một chất chính là lượng chất chứa NA phân tử của chất đó. Ví dụ: 1 mol phân tử O₂ có chứa 6,022.10²³ phân tử O₂.
Nồng độ mol là gì? Công thức tính
Nồng độ mol biểu thị cho số mol của một chất cho trước tan trong dung dịch (kí hiệu là M). Ví dụ: Trong 4 lít dung dịch có chứa 2 mol hạt tan sẽ tạo nên dung dịch 0,5 M hay còn gọi là 0,5 phân tử gam.

Nồng độ mol là số mol của một chất cho trước tan trong dung dịch
Ngày này, mol còn được dùng để thể hiện số lượng nguyên tử, ion hay các thực thể khác trong mẫu nhất định của một chất. Nồng độ dung dịch thường được biểu thị bởi số mol, hiểu đơn giản là lượng chất hòa tan trên một đơn vị thể tích dung dịch, đơn vị sử dụng là mol trên lít (mol/ l).
Công thức tính nồng độ mol: CM =nVdd . Trong đó:
- CM: nồng độ mol
- n: số mol chất tan
- Vdd: thể tích dung dịch (lít)
Ví dụ: Tính nồng độ mol của dung dịch 20 gam NaCl hòa tan trong 600ml nước. Đầu tiên, tra bảng tuần hoàn hóa học để xác định khối lượng riêng của Na và Cl.
- Na = 23 g/mol
- Cl = 35,5 g/mol
- NaCl = 23 g/mol + 35,5 g/mol = 58,5 g/mol.
=> Tổng số mol = 2058.5 = 0.34 mol.
Dựa vào công thức trên, ta sẽ tính được nồng độ mol bằng cách lấy số mol chất tan chia cho thể tích dung dịch: M = 0.340.6=0.56M (Lưu ý: 600ml = 0.6l).
Số mol là gì?
Số mol là khối lượng mol được tính bằng gam của N nguyên tử hoặc phân tử đó. Khối lượng mol được kí hiệu là M, đơn vị g/mol. Khối lượng mol có cùng số trị với nguyên tử khối hay phân tử khối của các nguyên tố trong bảng hệ thống tuần hoàn.

Số mol là khối lượng mol được tính bằng gam của N nguyên tử hoặc phân tử
Ví dụ:
- Khối lượng mol nguyên tử Cacbon (C): MC=12 (g/mol)
- Khối lượng mol nguyên tử Nitơ (N): MN=14 (g/mol)
- Khối lượng mol phân tử Amoniac (NH₃): MNH₃=17 (g/mol)
- Khối lượng mol phân tử Nitơ (N₂): MN₂=18 (g/mol)
Một số công thức tính số mol đơn giản:
Tính số mol qua qua khối lượng: n=mM
Trong đó:
- n: Số mol chất, tính bằng (mol).
- m: Khối lượng của chất đó, đơn vị (g)
- M: Khối lượng mol chất (bằng nguyên tử khối hay phân tử khối chất đó), tính bằng g/ mol.
Tính số mol qua thể tích: n=V22.4
Trong đó:
- n: Số mol chất khí ở điều kiện tiêu chuẩn (đktc), đơn vị tính là mol.
- V: Thể tích chất khí ở đktc, tính bằng lít.
Tính số mol khi biết nồng độ: n = CM.V
Trong đó:
- n: Số mol chất (mol)
- CM: Nồng độ mol (mol/ lít)
- V: Thể tích dung dịch (lít)
Tính số mol khi biết nguyên tử/ phân tử: n = AN
Trong đó:
- A: Số nguyên tử hoặc phân tử
- N: Số Avogadro (đơn vị trong bất cứ một mol chất nào và có giá trị 6.1023).
Tính số mol khí ở điều kiện thường: n=P.VR.T
Trong đó:
- P: Áp suất (1atm = 760mmHg)
- V: Thể tích (lít)
- R: Hằng số (0.082 hoặc 62400)
- T: Nhiệt độ tính theo độ Kelvin (K = 273 + ºC)
Nhiệt dung mol là gì?
Nhiệt dung mol là nhiệt năng cần thiết để nâng mức nhiệt của một mol vật chất lên 1ºC. Công thức được viết dưới dạng jun chia số mol trên độ C. Nhiệt độ có thể được biểu thị bằng độ Kelvin.
Tham khảo các bài tập tính nồng độ mol
Bài tập 1: Trong 400ml dung dịch có chứa 32 gam chất NaOH hòa tan, hãy tính nồng độ mol của dung dịch.
- Đổi 400 ml = 0.4 lít
- nNaOH = 36/40 = 0.9 mol
=> Theo công thức tính CM ta có: Cdd = n/V = 0.9/0.4 = 2.25 (M)
Một số bài tập hóa học liên quan đến mol
Bài tập 2: Tính CM của 0.5 mol MgCl2 có trong 1.5 lít dung dịch
=> Áp dụng vào công thức tính CM, ta có: CM = 0.51 x 5 = 0.33 (mol)
Bài tập 3: Tính nồng độ mol của dung dịch có chứa 0.5 mol NaCl trong 5 lít dung dịch đó.
=> CM = 0.5/5 = 0.1 (mol)
Bài tập 4: Tính nồng độ mol của dung dịch khi hòa tan 15.8g KMnO4 trong 7.2 lít nước.
=> Số mol của chất nKMnO4 = 15.8/ 158 = 0.1 (mol)
=> CM sẽ bằng: 0.1/ 7.2 = 0.0139
Bài tập 5: Cho 6.5 gam kẽm phản ứng vừa đủ với 100ml dung dịch axit clohidric (HCl). Hãy tính:
a, Thể tích của H₂ thu được ở điều kiện tiêu chuẩn.
b, Nồng độ mol của dung dịch HCl đã sử dụng.
Lời giải: Theo đề bài ta có: nZn = 6.5/ 65 = 0.1 mol
=> Phương trình phản ứng: Zn + 2HCl → + H₂
- nZn = nZnCl₂ = 0.1 mol
- nHCl = 2nZn = 0.2 mol
Đáp án: a, VH₂ = 0.1 x 22.4 = 2.24 lít; b, CddHCl = 0.2/ 0.1 = 2M
Hy vọng qua bài viết trên đây, các bạn đã hiểu mol là gì, cùng một số khái niệm cơ bản hóa học về đơn vị mol. Bên cạnh đó là công thức tính và bài tập liên quan mong rằng sẽ giúp hữu ích, giúp các bạn hiểu rõ hơn về đơn vị này và áp dụng trong học tập và công việc của mình.